繼上次發表的Guide RNA設計和篩選的相關知識之后,希望大家還沒有忘記相關的操作和技巧,今天,我們就來和大家聊聊后續的實驗,在基因編輯鼠的過程中,sgRNA表達載體是如何構建的呢?
在靶點篩選結束之后,下一步就要進行sgRNA載體構建。在構建表達載體前,應根據實驗目的選取合適的表達質粒。比如進行實驗時考慮是否需要reporter標簽,是否需要藥物篩選基因等。
接下來以構建px330質粒為例,具體說明如何構建sgRNA表達載體。(圖1)
先確定20bp靶標序列(基因組序列應為20bp+NGG);
如20bp第一個為G,則略過此部分;在20bp前額外添加一個G,形成G+20bp序列(U6 human promoter轉錄時需要起始堿基為G);
在20bp或G+20bp 5’前添加caccg,形成cacc-G+20bp序列,則為Forward序列(直接合成即可);
將20bp或G+20bp 進行反向互補,并在5’前添加aaac,則為Reverse序列(直接合成即可);
合成的sgRNA正反向堿基(摩爾濃度為100μM)進行退火,使之堿基配對并形成雙鏈結構;
BbsI酶切px330質粒,并對酶切后的載體進行回收;
將退火配對后的sgRNA堿基用超純水按1:200稀釋,并與回收后的載體進行連接;
連接產物進行轉化,氨芐抗性固體培養板進行涂板;
挑取單克隆菌落,擴大培養后提取質粒,并使用human U6通用引物對連接載體進行測序,檢測sgRNA 堿基片段是否正確插入px330質粒。
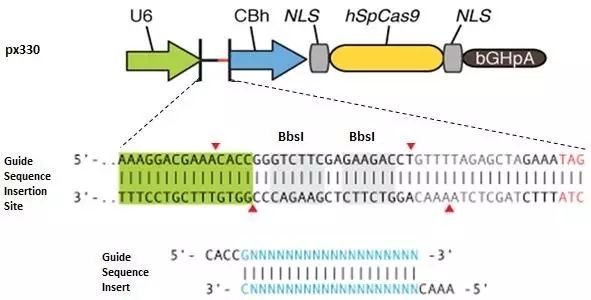
圖1.px330 sgRNA表達載體構建示意圖
然而,在進行受精卵顯微注射時為了增加基因編輯的效率,一般以RNA形式替代DNA質粒形式。以下為構建sgRNA體外轉錄載體pGS3-T7-sgRNA步驟。(圖2)
確定20bp sgRNA靶序列,按上述操作將其連接至BbsI酶切的pGS3-T7-sgRNA中,測序并挑選正確插入的質粒;
pGS3-T7-sgRNA質粒線性化:用DraI酶切1μg pGS3-T7-sgRNA質粒,37℃反應3h;
以構建正確的pGS3-T7-sgRNA為模板,配制體外轉錄反應溶液(體系見表1);
將上述溶液均勻混合后輕微離心,將轉錄反應液收集于反應管底部,42℃反應 2 小時;
加3μl RNase-Free DNase I至20μl反應體系中,充分混合后置于37℃反應30min;
加77μl RNase-free 純水以終止反應繼續進行;
使用酚氯仿和異丙醇方法純化轉錄后的RNA;
取反應液的一部分進行4% 瓊脂糖凝膠電泳,確認體外轉錄后的 RNA 產物;
測定RNA濃度,用以顯微注射。

圖2. pGS3-T7-sgRNA載體構建及體外轉錄示意圖
|
試劑 |
用量 |
|
Transcription buffer ,10 x |
2μl |
|
Template DNA ,200ng/μl |
5μl |
|
ATP ,50mM |
2μl |
|
GTP ,50mM |
2μl |
|
CTP ,50mM |
2μl |
|
UTP ,50mM |
2μl |
|
Rnase inhibitor ,40U |
0.5μl |
|
RNA polymerase , 50U |
2μl |
|
RNase-free H2O |
2.5μl |
表1. sgRNA T7-體外轉錄反應體系
Cas9表達載體體外轉錄步驟。(圖3)
pSP6-Cas9質粒線性化:用NotI單酶切5μg pSP6-Cas9質粒,37℃反應5h;
0.8%或1%瓊脂糖凝膠電泳,并進行DNA凝膠純化回收,測定濃度;
以純化DNA為模板,按mMessage mMachine SP6體外轉錄試劑盒說明書配制反應溶液(體系見表2);
將上述溶液均勻混合后輕微離心,將轉錄反應液收集于反應管底部,37℃反應 2 h;
加1μl TURBO DNase至反應溶液中,混勻并在37℃反應15min;
加30μl nuclease-free 純水及30μl 氯化鋰溶液,混勻溶液并在-20℃冷凍30min;
4℃、14,000g離心10min以沉淀mRNA,小心去除上清溶液。并用500μl 70%乙醇清洗一遍,同時再次4℃、14,000g離心10min;
吸凈上清乙醇溶液,室溫干燥5min,最后用20μl RNase-free 純水溶解mRNA沉淀,混勻后置冰上并測定濃度,最后置于-80℃或-150℃保存。

圖3. pSP6-Cas9載體構建及體外轉錄示意圖
|
試劑 |
用量 |
|
Transcription buffer ,10 x |
2μl |
|
Template DNA ,200ng/μl |
5μl |
|
SP6 NTP/CAP ,2 x |
2μl |
|
SP6 enzyme mix |
2μl |
|
RNase-free H2O |
9μl |
表2. Cas9 mRNA SP6-體外轉錄反應體系
參考文獻:
Shao Y et al., CRISPR/Cas-mediated genomeediting in the rat via direct injection of one-cell embryos. Nat Protoc. 2014Oct;9(10):2493-512.
美國科研團隊在新一期《自然·生物技術》雜志發表研究成果稱,他們基于逆轉錄酶開發出一種新型基因編輯技術,能夠更精準、更高效地同時修復哺乳動物細胞內的多個致病突變,為開發廣譜基因療法奠定了重要基礎。許多遺......
隨著CRISPR基因編輯技術的不斷進步,科學家已將其應用于馬、綿羊、豬等動物的遺傳改良。英國《自然》網站在日前的報道中指出,經過基因編輯的豬和綿羊等動物,正逐漸在農業領域獲得認可。這些技術可提升動物的......
記者27日從中國農業科學院獲悉,該院農業基因組研究所農業基因編輯技術研發與應用創新團隊構建了全球規模最大的實驗驗證數據集,并基于此開發出人工智能(AI)大模型AlphaCD。該模型不僅能高效預測超過2......
廣州醫科大學附屬第一醫院國家呼吸醫學中心主任何建行與合作者在一項研究中發現,一個經過基因工程修飾的豬肺在移植到一名確診腦死亡的人類患者體內后,能存活9天并發揮功能。研究結果或是跨物種肺移植的首例記錄,......
近日,中國農業科學院農業基因組研究所農業基因編輯技術研發與應用創新團隊構建了迄今為止規模最大的實驗驗證數據集,并在此基礎上開發了多模態機器學習模型AlphaCD。該模型不僅能夠高效預測超過2萬種胞嘧啶......
近日,美國哈佛大學與杰克遜實驗室聯合團隊運用先導編輯技術,在小鼠模型中實現了對兒童交替性偏癱(AHC)致病基因突變的精準修正。此前,中國上海交通大學醫學院松江研究院仇子龍教授團隊曾證實,全腦堿基編輯技......
瑞典烏普薩拉大學研究團隊在6日出版的《新英格蘭醫學雜志》發表成果稱,全球首例由CRISPR-Cas基因編輯技術獲得的供體胰島β細胞,在未使用免疫抑制劑的情況下,在Ⅰ型糖尿病患者體內成功存活,并發揮功能......
神經元中基因編輯的插圖。圖片來源:杰克遜實驗室哪怕在五年前,人們也會認為在活體大腦中進行DNA修復是科幻小說中才有的情節。但現在,科學家已能進入大腦、修復突變,并讓細胞在整個生命周期中維持住這種修復效......
美國得克薩斯大學西南醫學中心研發的新型基因編輯遞送系統,在α-1抗胰蛋白酶缺乏癥(AATD)臨床前模型上實現了肝臟與肺部的同步靶向治療。單次給藥后,模型癥狀改善效果可持續數月。這項發表于最新一期《自然......
新一期《自然·通訊》雜志發表一項基因組學重大突破:美國耶魯大學團隊成功將在同一細胞中編輯多個DNA位點的能力提升了2倍,并有效減少了對附近基因位點的非預期突變。新成果使基因編輯的范圍和精度同時得以擴大......